中国科学院上海营养与健康研究院潘巍峻研究员带领其研究团队,在国际上首次高清晰解析了体内造血干细胞归巢的完整动态过程,该研究成果于北京时间2018年11月20日凌晨在国际知名学术期刊《Nature》在线发表。
图片来源:Nature
造血干细胞
人体的血液中包含红细胞、白细胞、血小板等各个类型的细胞。它们形态各异、各司其职,但却拥有着共同的来源——造血干细胞。
作为人体血液系统中的始祖细胞,造血干细胞具有自我更新能力,可通过增殖、分化,产生全部血细胞类型,维持生命。
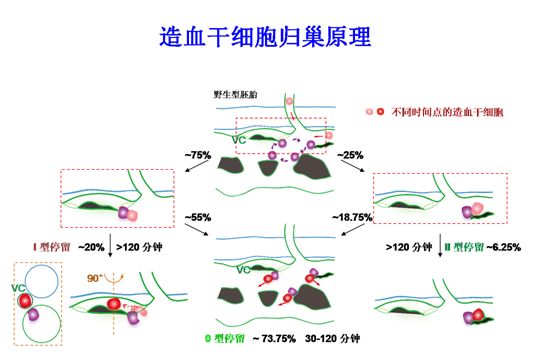
造血干细胞在循环系统中寻找其最适宜的微环境的过程被称为“归巢”,只有寻找到自己的“家”,造血干细胞才能有效发挥其功能。在健康的生理状态下,造血干细胞仿佛携带一部GPS,总能找到其最佳位置。
造血干细胞归巢的概念由来已久,基于其归巢能力的造血干细胞移植已在临床被广泛应用于血液、免疫和肿瘤等重大疾病的治疗。但由于该生命过程的时空跨度非常大,观察手段十分有限。虽然科研人员在过去几十年的研究过程中,对归巢的细胞和分子基础进行了一定的解析,但归巢在体内究竟如何发生,归巢的微环境究竟是何种结构,微环境细胞又是如何帮助造血干细胞归巢的等一系列关键科学原理依然知之甚少,严重制约了临床造血干细胞移植等相关技术的发展。
攻坚克难
然而,由于“造血干细胞归巢”这一生命过程的时空跨度非常大,其具体发生机制一直不为人知。
潘巍峻研究员及其核心研究团队:后排从左向右为此项研究成果的共同第一作者李美、李丹彤、薛文志。(图片来源:中国科学院上海营养与健康研究院)
为攻克该科学难题,中科院上海营养与健康研究院潘巍峻研究员带领其研究团队,历时6年,整合了遗传调控、免疫荧光标记和活体成像等多种技术,形成了一套全新的研究体系。
该系统可以在体内直接观测新生造血干细胞归巢的完整过程。通过大量统计学分析和实验验证,该研究团队首次阐明了造血干细胞归巢的时空规律,找到了造血干细胞在造血组织中归巢停留的“热点区域”及其中特殊的静脉微血管结构。
共聚焦显微镜活体观察早些干细胞归巢
显微注射
此外,在归巢停留的“热点区域”中,他们还发现了一种可以识别并且引导干细胞归巢的巨噬细胞新亚群,并将其命名为“先导细胞”。
“先导细胞”引导造血干细胞进入血管微环境的原理图(紫色细胞为“先导细胞”,VC指示静脉微血管,绿色代表血管)
意义重大
总结来说,该研究首次通过活体成像直观记录了归巢各个阶段细胞与微环境的相互作用机制,阐明了该生命过程中不同组织细胞之间的动态协作过程。这些发现极大丰富了现有的对造血干细胞归巢机制的科学认识。
这是由中国科学家独立完成的原创性科学发现,研究过程中突破了现有理论及研究体系,以独特的视角呈现了造血干细胞在生物体内归巢的全过程。开启了国际上造血干细胞领域的在体长时程、高分辨研究新时代。
复旦大学附属华山医院血液科主任陈彤教授表示,这一发现预示着今后在临床进行造血干细胞移植时可以靶向的、定向诱导造血干细胞的归巢,从而大大提高以后造血干细胞移植的成功率。
《自然》期刊高级编辑Natalie Le Bot评价称,中科院科学家完成这项出色的工作依赖于中国对基础研究的长期投入,这一研究结果有望成为将来提高骨髓移植成功率的关键。
本文信息来源“央视新闻、中国科学院上海营养与健康研究院”
河北省干细胞库整理、编辑
 电话咨询:400-880-9135
电话咨询:400-880-9135
 电话咨询:400-880-9135
电话咨询:400-880-9135